Genç kızlarda ergenlik döneminin çoğunlukla ilk belirtisi olan meme gelişimi 8 ile 13 yaşları arasında başlamaktadır. Meme gelişimi genellikle 18 yaşına kadar tamamlanmakla birlikte bazen 20 li yaşlara kadar devam etmektedir.
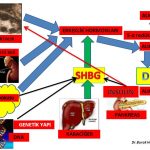
Meme gelişimini ve büyümesini (hücre çoğalması) büyük oranda iki temel faktör belirlemektedir;
1-Genetik (Ailesel); Aile hikayesi polikistik over sendromu olmayan kişilerde meme gelişimi ve büyüklüğü üzerine oldukça fazla belirleyici etkiye sahiptir. Fakat, polikistik over sendromu’nda genetik etkilerle birlikte erkeklik hormonları (testosteron, dihidrotestosteron) da meme gelişimi ve büyümesini etkilemektedir. 2-Hormonlar; Ergenlikle birlikte yumurtalıklarda daha fazla miktarda üretilmeye başlanan östrojen hormonu meme dokusunda bulunan östrojen alıcılarına (ERα) ve progesteron hormonu progesteron alıcılarına tutunarak meme gelişimini ve büyümesini sağlamaktadır(1,2,3,4,16).Erkeklik hormonları (testosteron ve dihidrotestosteron) meme dokusunda bulunan erkeklik hormonu alıcılarına (reseptör) tutunarak östrojen hormonuna ters bir etki gösterip meme gelişimini ve büyümesini engellemektedir(5,6,13,14,15,17). Östrojen (Estradiol) ve erkeklik hormonlarının miktarlarında meydana gelen artış veya azalışlar meme gelişimi ve büyümesinde değişikliklere neden olurlar.
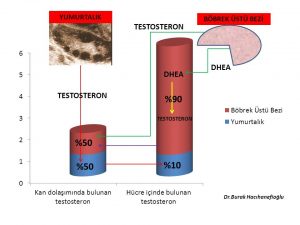
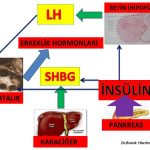
Erkeklik hormonlarının (testosteron, dihidrotestosteron) büyük bir kısmı böbrek üstü bezinde (Adrenal Gland) üretilen DHEA (Dehydroepiandrosterone) ve Androstenedione hormonlarını hammadde olarak kullanarak deri ve meme ve yağ dokusu gibi aynı zamanda erkeklik hormonlarının (testosteron, dihidrotestosteron) hedefi olan organlarda üretilirken ancak küçük bir kısmı yumurtalık ve böbrek üstü bezinde üretilmektedir (Intracrinology)(18,19).
Kan dolaşımında bulunan testosteron miktarı sadece yumurtalık ve böbrek üstü bezinden direk olarak salınan miktarı göstermektedir. Kadınlarda testosteron hormonunun büyük kısmının üretildiği meme, deri, yağ dokusu gibi organlardan ancak küçük bir miktar (%10) testosteron kan dolaşımına girmektedir(20).
Kan dolaşımına girmeyen testosteron hormonunun büyük çoğunluğu ise 5- α reduktaz (reductase) enzimi tarafından dihidrotestosteron (dhydrotestosterone) hormonuna dönüşmektedir(21,22,23). Dihidrotestosteron hormonu testosteron hormonundan 10 kat daha güçlü bir etkiye sahiptir(24).
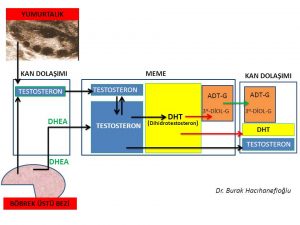
Dihidrotestosteron hormonunun da testosteron hormonu gibi büyük çoğunluğu (%90) kan dolaşımına girmemektedir(23). Meme, deri ve yağ hücresinde üretilen dihidrotestosteron (DHT) hormonunun büyük çoğunluğu UGT- enzimi ile herhangi bir hormon etkisi olmayan ürünler (metabolit) olan 3 α- androstanediol glucuronide (3α diol G) ve androsterone Glucuronide (ADT-G) dönüşerek meme, deri ve yağ hücresinden kan dolaşımına girmektedir(25,26,27,28,29). Kan dolaşımına katılan 3 α- androstanediol glucuronide (3α diol G) ve androsterone Glucuronide (ADT-G) idrar yolu ile vücuttan atılmaktadır(25,26,27,28,29).
Üreme çağındaki kadınlarda adet döngüsünün ortasına doğru olan dönemde testosteron ve östrojen hormonları fazla miktarda üretilir, fakat yumurtlama sonrası (luteal faz) dönemde testosteron hormonu miktarı azalmaya başlarken, östrojen hormonu miktarı fazla miktarda üretilmeye devam eder (7). Bu nedenle meme büyümesi (hücre çoğalması) en fazla yumurtlama sonrası dönemde (luteal) görülmektedir(8). Östrojen hormonu miktarının en az olduğu buna karşılık testosteron hormonunun fazla olduğu yumurtlama öncesi dönem içinde (foliküler faz) meme gelişimi durmakta ve hatta meme küçülmesi (apoptosis) olmaktadır(7).
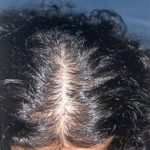
Menopoz sonrasında östrojen miktarı testosteron miktarına göre çok daha fazla azalmaktadır(7). Testosteron hormonu miktarının östrojen hormonu miktarından fazla olması menopoz sonrasında meme dokusunun küçülmesine (atrofi) neden olmaktadır. Erkeklik hormonu ilaçlarının kullanılmasına bağlı olarak kadın sporcular (atletler) ve cinsiyet değiştirenler (erkek cinsiyeti tercih eden kadınlar) de meme dokusunda küçülme ortaya çıkmaktadır(9,10,11). Genetik olarak (Doğuştan) erkeklik hormonu alıcıları olmayan erkeklerde (Androgen insensitivity syndrome) erkeklik hormonları çalışmamaktadır. Bu nedenle östrojen hormonunun meme büyütücü etkisine karşı koyacak erkeklik hormonu etkisi olmadığı için bu erkeklerde meme gelişimi ve büyüklüğü kadınlarda olduğu gibi tam olarak oluşmaktadır (12).
Polikistik over sendromu olan kadınların bir kısmında (grup A ve C) özellikle meme gelişimi ve büyümesine etki eden erkeklik hormonları (testosteron ve dihidrotestosteron) ergenlik döneminde fazla miktarda üretilmektedir.
Polikistik over sendromu olan kadınların bir kısmı ergenlik döneminde meme gelişimi ve büyümesi sırasında östrojen hormonuna karşı fazla miktarda erkeklik hormonuna maruz kalmaktadır. Bu kadınlarda maruz kaldıkları erkeklik hormonu miktarına paralel olarak meme gelişimi ve büyümesi yavaşlamaktadır. Hatta bu kişilerde erkeklik hormonu miktarının ne kadar fazla üretildiğine bağlı olarak meme büyümesi durabilmektedir.
Tedavi;
Polikistik over sendromu’nun meme gelişimi ve büyümesi süreci tamamlanmadan daha önce erken teşhis edilmesi ve tedaviye başlanılması fazla miktarda üretilen erkeklik hormonlarının meme üzerine olan olumsuz etkilerini engellemektedir.
Tedavi Yöntemleri;
Dihidrotestosteron hormonuna dönüşen erkeklik hormonlarının (testosteron, androstenedione, DHEAS) etkinliğinin ve miktarının azaltılması, dihidrotestosteron hormonuna dönüşümün azaltılması ve Sex Hormon Binding Globulin miktarının arttırılması sonucunda kan dolaşımında serbest bulunan erkeklik hormonlarının etkin formlarının (serbest testosteron) miktarının azaltılması tedavinin temel amacıdır.
1-İnsülin direnci olan kadınlarda insülin duyarlılığının ilaç tedavisi ile arttırılmasına bağlı olarak kan dolaşımında bulunan insülin miktarının azalması yumurtalıkta fazla miktarda üretilen erkeklik hormonlarını (androstenedione, testosteron) azaltmaktadır(30,31). İnsülin direncinin azalması aynı zamanda karaciğerde üretilen SHBG miktarını arttırmakta ve erkeklik hormonlarının serbest dolaşan etkin formlarının (serbest testosteron ) miktarının azalmasına neden olmaktadır(30,31).
2-Kan dolaşımında bulunan erkeklik hormonlarının bir kısmı meme hücresinde bulunan alıcılara (androgen receptor) tutunarak etki etmektedir. Erkeklik hormonlarının alıcılara tutunmasının engellenmesi (androgen receptor antagonist) diğer bir tedavi seçeneğidir(32,33,34). Bu amaçla kullanılan ilaçların (androgen receptor antagonist) doğum kontrol hapları gibi hayati tehlikeye sahip yan etkileri ( bacak damarlarının pıhtı ile tıkanması ve ordan kopan pıhtı parçasının da akciğer damarlarını tıkaması ve meme kanseri) yoktur(35,36). 3-Alıcılara (receptor) tutunarak meme hücresi içine giren testosteron ile hücre içinde üretilen testosteron hormonunun büyük çoğunluğu 5- α reduktaz (reductase) enzimi tarafındandihidrotestosteron (dhydrotestosterone) hormonuna dönüşmektedir(20,21,22). 5- α reduktaz (reductase) enziminin bu etkisinin engellenmesi ( 5- α reductase inhibitor) de bir tedavi seçeneğidir(37). Bu amaçla kullanılan ilaçların ( 5-α reductase inhibitor) doğum kontrol hapları gibi hayati tehlikeye sahip yan etkileri ( bacak damarlarının pıhtı ile tıkanması ve ordan kopan pıhtı parçasının da akciğer damarlarını tıkaması ve meme kanseri) yoktur(38).Kaynaklar
1-Estrogen and progesterone in normal mammary gland development and in cancer. Stingl J. Horm Cancer. 2011 Apr;2(2):85-90.
2-Form and function: how estrogen and progesterone regulate the mammary epithelial hierarchy. Arendt LM, Kuperwasser C. J Mammary Gland Biol Neoplasia. 2015 Jun;20(1-2):9-25.
3-Dissociation between steroid receptor expression and cell proliferation in the human breast. Clarke RB, Howell A, Potten CS, Anderson E. Cancer Res. 1997 Nov 15;57(22):4987-91.
4-Pattern of distribution of cells positive for estrogen receptor alpha and progesterone receptor in relation to proliferating cells in the mammary gland. Russo J, Ao X, Grill C, Russo IH. Breast Cancer Res Treat. 1999 Feb;53(3):217-27.
5-Differential effects of exogenous androgen and an androgen receptor antagonist in the peri- and postpubertal murine mammary gland. Peters AA, Ingman WV, Tilley WD, Butler LM. Endocrinology. 2011 Oct;152(10):3728-37.
6-Minireview: The androgen receptor in breast tissues: growth inhibitor, tumor suppressor, oncogene? Hickey TE, Robinson JL, Carroll JS, Tilley WD. Mol Endocrinol. 2012 Aug;26(8):1252-67.
7-Reexamination of testosterone, dihydrotestosterone, estradiol and estrone levels across the menstrual cycle and in postmenopausal women measured by liquid chromatography-tandem mass spectrometry. Rothman MS, Carlson NE, Xu M, Wang C, Swerdloff R, Lee P, Goh VH, Ridgway EC, Wierman ME. Steroids. 2011 Jan; 76(1-2) : 177-82.
8-Estrogens, progestogens, normal breast cell proliferation, and breast cancer risk. Pike MC, Spicer DV, Dahmoush L, Press MF. Epidemiol Rev. 1993; 15(1):17-35.
9-Indications of prevalence, practice and effects of anabolic steroid use in Great Britain. Korkia P, Stimson GV. Int J Sports Med. 1997 Oct;18(7):557-62.
10-An immunohistochemical study of the long-term effects of androgen administration on female-to-male transsexual breast: a comparison with normal female breast and male breast showing gynaecomastia. Burgess HE, Shousha S. J Pathol. 1993 May;170(1):37-43.
11-Histology of genital tract and breast tissue after long-term testosterone administration in a female-to-male transsexual population. Grynberg M, Fanchin R, Dubost G, Colau JC, Brémont-Weil C, Frydman R, Ayoubi JM. Reprod Biomed Online 2010 Apr;20(4):553-8.
12-Molecular biology of androgen insensitivity. Jääskeläinen J. Mol Cell Endocrinol. 2012 Apr 16;352(1-2):4-12.
13-A physiologic role for testosterone in limiting estrogenic stimulation of the breast. Dimitrakakis C, Zhou J, Wang J, Belanger A, LaBrie F, Cheng C, Powell D, Bondy C. Menopause. 2003 Jul-Aug;10(4):292-8.
14-Cloning of human androgen receptor complementary DNA and localization to the X chromosome. Lubahn DB, Joseph DR, Sullivan PM, Willard HF, French FS, Wilson EM. Science. 1988 Apr 15;240(4850):327-30.
15-Characterization and expression of a cDNA encoding the human androgen receptor. Tilley WD, Marcelli M, Wilson JD, McPhaul MJ Proc Natl Acad Sci U S A. 1989 Jan;86(1):327-31.
16-Sequence and expression of human estrogen receptor complementary DNA. Greene GL, Gilna P, Waterfield M, Baker A, Hort Y, Shine J. Science. 1986 Mar 7;231(4742):1150-4.
31- Treatment Options for Hirsutism: A Systematic Review and Network Meta- Analysis . Barrionuevo P, Nabhan M, Altayar O, Wang Z, Erwin PJ, Asi N, Martin KA, Murad MH. J Clin Endocrinol Metab. 2018 Apr 1;103(4):1258-1264.
32-The endocrine effects of spironolactone used as an antiandrogen. Young RL, Goldzieher JW, Elkind-Hirsch K. Fertil Steril. 1987 Aug;48(2):223-8. 33-A systematic review of commonly used medical treatments for hirsutism in women. Koulouri O, Conway GS. Clin Endocrinol (Oxf). May;68(5):800-5. 34-Comparison of spironolactone, flutamide, and finasteride efficacy in the treatment of hirsutism: a randomized, double blind, placebo-controlled trial. Moghetti P, Tosi F, Tosti A, Negri C, Misciali C, Perrone F, Caputo M, Muggeo M, Castello R. J Clin Endocrinol Metab. 2000 Jan;85(1):89-94. 35-Spironolactone and risk of incident breast cancer in women older than 55 years: retrospective, matched cohort study. Mackenzie IS, Macdonald TM, Thompson A, Morant S, Wei L. BMJ. 2012 Jul 13;345:e4447. 36-Spironolactone use and risk of incident cancers: a retrospective, matched cohort study. Mackenzie IS, Morant SV, Wei L, Thompson AM, MacDonald TM. Br J Clin Pharmacol. 2017 Mar;83(3):653-663. 37-Spironolactone use and the risk of breast and gynecologic cancers. Biggar RJ, Andersen EW, Wohlfahrt J, Melbye M. Cancer Epidemiol. 2013 Dec;37(6):870-5. 38-Adverse Effects and Safety of 5-alpha Reductase Inhibitors (Finasteride, Dutasteride): A Systematic Review. Hirshburg JM, Kelsey PA, Therrien CA, Gavino AC, Reichenberg JS. J Clin Aesthet Dermatol. 2016 Jul;9(7):56-62.Bunları da İnceleyin;
 Polikistik Over
Polikistik Over